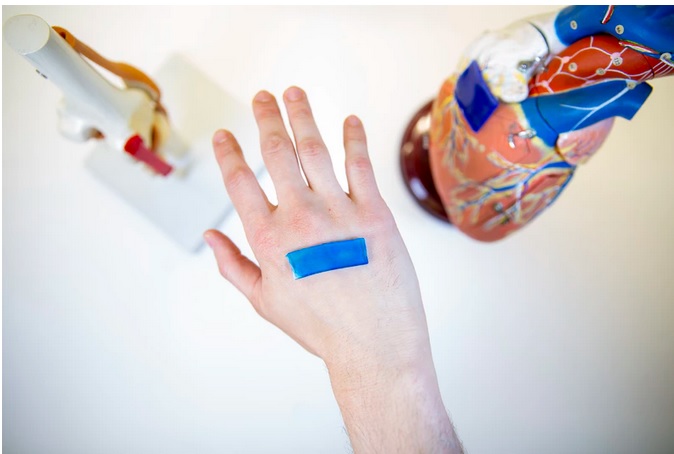
Ce nouveau dispositif de pansement adhésif actif, développé à l’Institut Wyss à Harvard, se contracte lorsqu'il atteint la température du corps, ce qui lui permet d'accélérer la cicatrisation des plaies cutanées ouvertes. Le dispositif, présenté dans la revue Science Advances pourrait également être utilisé pour fermer des plaies sur des tissus internes tels que le cœur, administrer des médicaments et fonctionner dans des thérapies basées sur la robotique douce. Un bel exemple de « mécanothérapie » intelligente et de nouvelles applications basées sur le rôle clé des forces physiques dans les processus biologiques.
Coupures, éraflures, ampoules, brûlures, piqûres et perforations, notre peau peut être blessée de mille manières. La plupart des traitements de ces plaies cutanées impliquent simplement de placer une barrière de type pansement de gaze adhésif pour maintenir la plaie humide, limiter la douleur et réduire l'exposition aux microbes, mais au-delà, n'interviennent pas de manière proactive dans le processus de cicatrisation. Des pansements intelligents capables de surveiller des aspects de la cicatrisation tels que le pH et la température et d'administrer des thérapies au site de la plaie ont été développés ces dernières années, leur fabrication reste complexe, coûteuse et difficile à personnaliser, ce qui limite leur potentiel d'utilisation en pratique clinique. A contrario, ce nouveau dispositif est basé sur un mécanisme physique exploitable dans de nouvelles approches thérapeutiques plus simples, pouvant même être plus efficaces que les médicaments ou certains dispositifs médicaux complexes actuellement en développement.
Un adhésif sensible à la chaleur, mécaniquement actif, extensible, résistant et antimicrobien
Les AADs : c’est donc une nouvelle approche d'accélération de la cicatrisation des plaies qui nous est présentée aujourd’hui, basée sur des hydrogels sensibles à la chaleur, mécaniquement actifs, extensibles, résistants, hautement adhésifs et antimicrobiens : les auteurs nomment ce dispositif « AAD » pour active adhesive dressing. Ces AAD sont capables de fermer les plaies bien plus rapidement que d'autres dispositifs et empêcher la croissance bactérienne sans nécessité de dispositif ou de protocole supplémentaire.
Les AADs s’inspirent de l’embryon en développement, dont la peau est capable de cicatriser complètement, sans formation de tissu cicatriciel. Pour y parvenir, les cellules cutanées embryonnaires autour d'une plaie produisent des fibres constituées de la protéine actine, ces fibres se contractent pour rapprocher les berges de la plaie, comme un cordon ferme un sac. Les cellules de la peau perdent cette capacité une fois que le fœtus a dépassé un certain âge et toute blessure qui survient ensuite induit une inflammation et la formation de cicatrices à la fin du processus de cicatrisation. Afin de reproduire les forces contractiles qui entraînent la fermeture des plaies cutanées embryonnaires, les chercheurs ont conçus des hydrogels adhésifs résistants, ajouté un polymère thermosensible qui repousse l'eau et se contracte à environ 90 ° C. L'hydrogel hybride résultant commence à se contracter lorsqu’il est exposé à la température corporelle et transmet la force de contraction du composant au tissu sous-jacent par l’intermédiaire de liens solides entre l’hydrogel d’alginate et le tissu. De plus, des nanoparticules d'argent sont incorporées pour assurer une protection antimicrobienne.
La preuve de concept chez l’animal : les chercheurs montrent l’efficacité de l’AAD chez le porc où le dispositif montre une bonne adhérence à la plaie, un délai plus rapide de cicatrisation et un effet antibactérien. Cette technologie apparaît d’ores et déjà plus efficace que les produits de protection des plaies les plus couramment utilisés, avant même de prendre en compte ses propriétés de fermeture des plaies, souligne l’un des chercheurs, Benjamin Freedman, qui dirige ce projet. Sur des échantillons de peau de souris, le dispositif permet également de réduire de 45% la taille de la plaie vs échantillons de peau non traités. Le DAA ne provoque ni inflammation ni de réponse immunitaire, ce qui suggère qu'il est sans danger pour une utilisation dans et sur les tissus vivants. Le degré de fermeture de la plaie obtenu avec le DAA a été ajusté au mieux par les chercheurs, de manière à rendre possible son application sur des blessures des articulations telles que le coude. Une simulation informatique de la fermeture de la plaie assistée par AAD prédit que la peau humaine pourrait se contracter à un taux comparable à celui observé sur la peau de souris, ce qui suggère un bénéfice clinique chez les patients humains.
La recherche se poursuit sur l'impact des signaux mécaniques exercés par l'AAD sur le processus biologique de cicatrisation de la plaie et sur le fonctionnement de l'AAD à différentes températures. Les chercheurs envisagent d’autres applications, dans la prise en charge des ulcères diabétiques et les escarres, pour l'administration de médicaments ou comme composants de thérapies basées sur la robotique douce.
Mais nous avons là un bel exemple de mécanothérapie et la promesse d’approches thérapeutiques plus simples, « pouvant même être plus efficaces que les médicaments ou les dispositifs médicaux complexes existants », conclut le Dr Donald Ingber, directeur fondateur du Wyss et professeur de biologie vasculaire.
Source: Science Advances 24 Jul 2019 DOI: 10.1126/sciadv.aaw3963 Bioinspired mechanically active adhesive dressings to accelerate wound closure (Visuel Wyss Institute at Harvard University)


