
Quand on traite d’ulcère du pied diabétique, l’objectif ultime reste d’essayer de raccourcir les délais de cicatrisation et de prévenir l'amputation. Ces travaux de l'Université de Wisconsin-Madison, en démontrant que les communautés microbiennes associées à ces plaies chroniques courantes chez les patients diabétiques ont une incidence sur le fait que ces plaies cicatrisent ou conduisent à l’amputation. Des résultats présentés dans la revue Cell Host & Microbe qui suggèrent que la surveillance des microbiomes des ulcères du pied diabétique pourrait fournir aux médecins et aux soignants des données précieuses sur la meilleure façon de traiter ces plaies chroniques, douloureuses et handicapantes.
Les ulcères du pied diabétique sont des plaies chroniques fréquentes chez les diabétiques : une personne diabétique sur 4 va développer un ulcère du pied. Alors que l'hyperglycémie entraîne un engourdissement et une analgésie qui rend la plaie indolore, la prise en charge de la plaie sera souvent tardive et ses délais de cicatrisation allongés. Ces plaies peuvent « durer » ainsi des mois, voire des années et constituent la principale cause d'amputation chez les patients diabétiques. Lorsque l’ulcère entraîne une amputation, les taux de mortalité dépassent 70%…
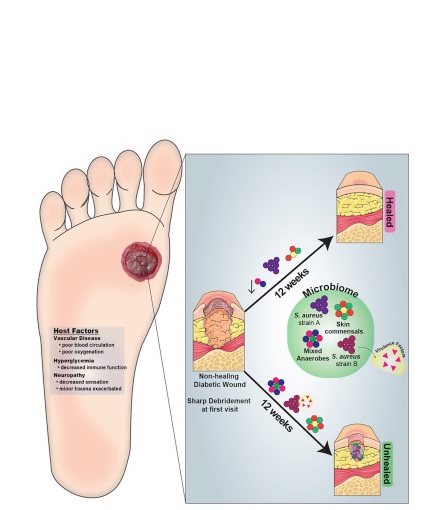
L’auteur principal, le Dr Lindsay Kalan, professeur de microbiologie médicale et d'immunologie à l'Université du Wisconsin et ses collègues de l'Université de Pennsylvanie révèlent ici que certaines souches de Staphylococcus aureus infectent exclusivement les ulcères du pied diabétique qui ne se guérissent jamais, indiquant ainsi ces souches vont retarder voire bloquer la cicatrisation.
Staphylococcus aureus et d’autres bactéries clés : Récemment, des scientifiques se sont mis à étudier le rôle que la colonisation bactérienne de ces plaies joue dans la cicatrisation, la chronicité ou l’absence de cicatrisation. Mais ces études reposaient sur des techniques à faible résolution qui ne permettaient d'identifier que de vastes groupes de bactéries dans les plaies, et non des membres spécifiques de la communauté. Ici, l’équipe s’est tournée vers le séquençage de l’ADN, qui permet d’identifier des espèces ou sous-espèces précises pour comprendre leur influence spécifique sur la cicatrisation. En pratique, les chercheurs ont recueilli ces données sur les microbiomes des ulcères de 46 patients juste avant le débridement de leurs plaies, un geste qui consiste à éliminer les tissus morts, nécrosés ou infectés pour tenter de relancer la cicatrisation. Ils ont ensuite collecté de nouveaux échantillons microbiens toutes les 2 semaines pendant 26 semaines tout en suivant l'évolution des ulcères. Le même travail a également été effectué chez la souris modèle d’ulcère diabétique.
- la bactérie S. aureus a été trouvée dans la grande majorité des blessures. Bien connu pour sa résistance aux antibiotiques, S. aureus est un agent pathogène commun et souvent difficile à traiter. Les données haute résolution sur des souches individuelles de S. aureus montrent que certaines souches ne sont identifiées que dans des plaies qui ne cicatrisent « jamais » ; l’étude du génome de ces souches montre en particulier qu’elles sont enrichies en facteurs de virulence tels que les entérotoxines et qu’elles possèdent davantage de gènes de résistance aux antibiotiques. Elles sont donc mieux équipées pour provoquer une infection plus invasive.
- au-delà du rôle délétère de Staphylococcus aureus somme toute logique, d'autres bactéries retrouvées couramment sur ces plaies peuvent soit altérer, soit améliorer le processus de cicatrisation : un autre membre commun des microbiomes de plaies, Alcaligenes faecalis, réduit la croissance et le risque d’infection des ulcères (ici chez la souris modèle). Les plaies infectées par Alcaligenes faecalis cicatrisent plus rapidement. A. Faecalis semble stimuler l’inflammation bénéfique de la peau blessée, ce qui indique que certains membres du microbiome pourraient même compenser les effets néfastes de bactéries plus nocives.
- Enfin, le débridement réduit la diversité des bactéries qui colonisent les plaies d'ulcères en voie de cicatrisation. L’étude du microbiome dans les 24 heures du débridement pourrait ainsi, suggèrent les chercheurs, détecter si le geste a été efficace ou non et si le processus de cicatrisation est relancé.
« Nous avons maintenant des preuves de l’utilisation possible du microbiome pour prédire les résultats de la cicatrisation et pour innover avec le développement de nouveaux traitements. Certes, il reste à identifier les bactéries qui jouent un rôle majeur et positif mais, en régulant le microbiome de la plaie, il serait ainsi possible de prévenir l'amputation ».
Dans l’attente, l’étude suggère que la surveillance des microbiomes des ulcères du pied diabétique pourrait guider les médecins et les soignants dans la prise en charge de ces plaies chroniques.
Source: Cell Host & Microbe April 18, 2019 DOI: 10.1016/j.chom.2019.03.006 Strain- and Species-Level Variation in the Microbiome of Diabetic Wounds Is Associated with Clinical Outcomes and Therapeutic Efficacy
Plus sur l’Ulcère du pied diabétique


